はじめに
パーキンソン病は中脳の黒質にあるドパミン神経細胞が何らかの原因で少なくなり、身体の運動の調節などに関係しているドパミンという物質が不足することにより発症します。1817 年にイギリス人外科医であるJames Parkinson が初めて報告し、その名前にちなんでパーキンソン病と呼ばれるようになりました。パーキンソン病はアルツハイマー型認知症に次いで頻度の高い神経変性疾患で、運動の不調をきたす神経変性疾患としては最も多いです。日本では人口10 万人あたり100 ~ 150人と推定され、2020年の厚生労働省の調査では患者総数は約29 万人と報告されています( 令和2 年度患者調査 総患者数,性・年齢階級× 傷病小分類別)。パーキンソン病は欧米では男性に多いのですが、日本では女性に多い病気です。50 ~ 65 歳に発症することが多いですが、高齢になるほど発病率が増加するため、人口高齢化が進む中で患者数は世界的に急増しています。パーキンソン病は感染症ではありませんが、その爆発的に増えている様子からParkinson Pandemic という造語も提唱されるほどです(Dorsey ER, et al. JAMA Neurol. 2018)。日本でも患者数は増加しており2018年度末には特定疾患の中で潰瘍性大腸炎を抜いて最多の疾患となりました。特に高齢パーキンソン病患者さんが急増しており、65歳以上の方では100人に1人の頻度の病気であることが示されています。もはや高齢者にとってはよくある病気といっても過言ではないパーキンソン病に対して最適な医療、看護、介護を提供し、患者さん、ご家族の健康を支えていくことは非常に大きな社会的なテーマであると我々は考えています。
概要
パーキンソン病は中脳黒質のドパミン神経細胞の変性・脱落により生じる疾患です。典型的な症例では運動緩慢、振戦(しんせん)、筋強剛(きんきょうごう)、姿勢反射障害などの運動症状と様々な運動以外の症状(非運動症状)がみられます。病理学的には、主に中脳の黒質や大脳基底核と呼ばれる部分の神経細胞に変性が見られ、神経細胞の数の減少と、αシヌクレインというタンパク質からなるレビー小体の蓄積が見られます。パーキンソン病の多くは孤発性ですが、5~10%は家族内発症者がいる遺伝性パーキンソン病です。孤発性パーキンソン病は複数のリスク遺伝子に環境要因が加わって発症に至ると考えられています。加齢も発症リスクの1つです。現段階では黒質のドパミン神経細胞の変性・脱落の原因は完全には明らかになっていません。
症状
パーキンソン病にみられる代表的な4つの症状は、運動緩慢、振戦、筋強剛、姿勢保持(反射)障害です。これらの運動症状は、左右どちらかの側から出現し、両側になったとしても、左右どちらかの症状がより強いというのが一般的な特徴です。近年、これらの運動に関係した症状に加え、様々な非運動症状(精神症状、自律神経障害、感覚障害、睡眠障害など)を呈することも明らかになりました。非運動症状の中には運動の不調をきたす前から認められる症状(うつ、便秘、嗅覚障害、レム睡眠行動異常症)もあり、パーキンソン病の早期診断という観点からも注目されています。しかし、これらの症状が全ての患者さんでみられるわけではなく、症状や経過に個人差が大きい病気です。多彩な症状を呈するため、病気の初期には脳神経内科ではなく総合内科、精神科、整形外科など他の科を受診する患者さんも多くいます。
ここでは、代表的なパーキンソン病の臨床症状について詳しく解説します。
スクロールしてください
慶應義塾大学病院KOMPASから許可を得て転載
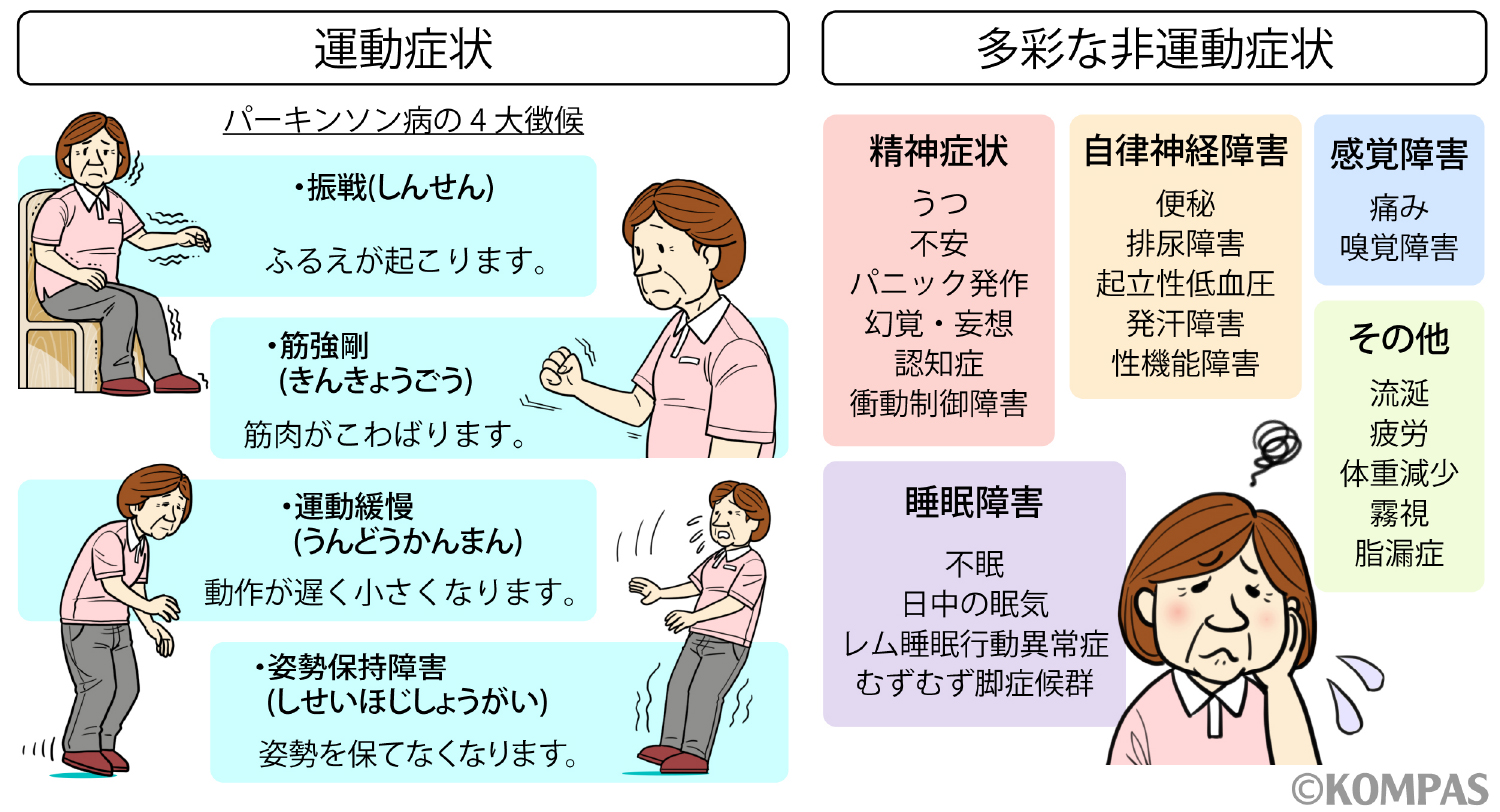
運動症状
図-1. パーキンソン病の4大徴候(https://kompas.hosp.keio.ac.jp/disease/000997/より引用)
パーキンソン病の症状の重症度分類としてはヤールの重症度分類(表-1)が用いられます。
スクロールしてください
| 重症度 | 主な症状および必要な介助状況 |
|---|---|
| Stage I | 片側の手足だけに振戦や筋強剛を示す。日常生活にほとんど介助を要さない。 |
| Stage Ⅱ | 両側に症状がみられ、姿勢の変化がかなり明確となる。日常生活がやや不便である。 |
| Stage Ⅲ | 明らかな歩行障害がみられ、方向転換の不安定など立ち直り反射障害がある。 日常生活の動作にもかなり障害がみられ、一部介助が必要となる。 |
| Stage Ⅳ | 起立や歩行など日常生活の動作が非常に困難となり、介助が必要となる。 |
| Stage Ⅴ | 自力での日常生活動作は難しく、介助による車椅子での移動またはベッド上の生活が中心となる。 日常生活では全面的な介助を必要とする。 |
運動緩慢・無動
動作が遅くなり、運動の大きさ(振幅)や量が減ってしまう症状です。症状がより高度になった状態を無動といいます。歩行・起き上がり・立ち上がり・寝返りなど様々な日常動作が障害されます。例えば、歩くのが遅くなったり、歩幅が小さくなったり(小刻み歩行)、食事動作、着脱衣、寝返りなどに支障をきたすことがあります。瞬きが少なく、仮面をかぶっているような表情のない顔つき(仮面様顔貌)、小声で単調な抑揚のない話し方になります。以前に比べて字が下手になり、書くにしたがって文字が小さくなること(小字症)や、症状の進行に伴い食事の咀嚼(そしゃく)や飲み込みが遅く下手になるなどの症状がみられることもあります。
振戦(しんせん)
手、足、あごや頭部に起こる「ふるえ」のことです。左右どちらかにより強いのが一般的です。ふるえがみられる病気は多くありますが、パーキンソン病のふるえは、膝の上に手を置いてリラックスしている時など安静にしていて動作をしていない時に強くふるえ、動作をすると軽くなったり、消失したりするのが特徴です。丸薬を丸めているような指の動きが特徴です(pill rolling tremorと言います)。振戦を認めないパーキンソン病の方もいます。
筋強剛(きんきょうごう)
筋肉の緊張が高まっている状態で、関節を曲げ伸ばしした際に抵抗を感じ、固く感じられます。例えば、診察室で医師が患者さんの腕を肘のところで曲げたり伸ばしたりした時に抵抗を感じます。患者さんご自身はやや気づきづらい症状です。カクカクと歯車のように抵抗を感じることもあれば、鉛の管を曲げるように一定の抵抗を感じる時もあります。手足だけではなく、頸部や胴体部分にも出現します。
姿勢保持障害
人間の体は、倒れそうになると倒れないために姿勢を反射的に直す反応が備わっています。しかし、パーキンソン病患者さんでは、前方や後方に軽く押されただけで体勢を立て直せずに突進したり倒れたりしてしまうことがあります。立ち上がった時、歩いている時や方向転換時に倒れやすくなります。通常、病気の初期には認めず、他の症状にて発症してから数年経過した頃にみられるようになります。
歩行障害
歩行が遅く、歩幅が狭く、自然な腕の振りが減ってしまいます。膝を曲げ前屈みの姿勢で小刻みに歩きます。また、足がなかなか前に出ない(すくみ足)、歩き出すと早足となってしまい止まることができない(加速歩行)といった症状がみられます。すくみ足は歩き始めや方向転換時に強く出やすく、歩幅にあった横線などの模様が床や地面に描いてあると、それをまたぎながら歩くことでスムーズに足がでるようになることがあります。
姿勢異常
筋強剛、ジストニア、筋力低下、固有感覚の障害などにより、比較的病初期から前傾姿勢、進行期には腰曲がり、首下がり、斜め徴候といった姿勢異常が目立つようになることがあります。
非運動症状
精神症状
抑うつ、アパシー(無気力、無関心)、不安、パニック発作がみられる場合があります。抑うつ症状が病初期から強く、精神科を最初に訪れることもあります。病気の進行期には幻覚(特に幻視が多い)、妄想を認めることがあります。また、物事をスムーズに行えなくなる遂行機能障害、注意障害、視空間認知障害などの認知機能障害を呈することもあります。主に薬の副作用で病的賭博や性欲亢進、買い物依存、過食などの衝動制御障害が出現することもあります。
自律神経障害
便秘が最も多い症状ですが、排尿障害(頻尿が多い)、起立性低血圧(立ちあがった時に血圧が下がってしまいたちくらみがしたり、ひどい時には失神したりすることもあります)、発汗過多、インポテンスなどの症状があります。
感覚障害
嗅覚障害、痛みが出現することがあります。嗅覚障害は高頻度で認められる症状ですが、患者さんは自覚していないことも多く、検査をして初めて気づくことも多いです。
睡眠障害
不眠、日中の眠気、むずむず脚症候群、レム睡眠行動障害(寝ている最中に大声を上げる、手足をバタつかせる)など多彩な症状が出現します。日中の眠気、突発的睡眠(予兆なく突然寝入ってしまう)はパーキンソン病自体の症状であると共に、パーキンソン病に対する薬の副作用で出現することもあります。
運動合併症
発症して数年が経ちますと、抗パーキンソン病薬(L-ドパ)の効いている時間が短くなり薬がきれる感じを自覚するようになります。薬が効いている時間(オン)と効いていない時間(オフ)で症状の差を感じるようになるということです。そのような薬の効果持続時間の短縮による症状の日内変動をウェアリングオフ現象といいます。また、主に抗パーキンソン病薬の血中濃度が高い時に出現する体をくねらせるような不随意運動をジスキネジア(peak-doseジスキネジア)といいます。ウェアリングオフ現象とジスキネジアをまとめて運動合併症といい、これらを認めるようなった患者さんを進行期と呼ぶのが一般的です。
診断・検査
パーキンソン病は、臨床所見(症状)、画像所見、治療の効果などから総合的に診断されます。
まずは運動緩慢がみられるかどうか、加えて振戦、筋強剛といった他の運動症状がみられるかどうか(パーキンソニズムがあるか否か)を確認します。また、レム睡眠行動障害や嗅覚障害、便秘など多彩な非運動症状の存在の有無も参考にします。パーキンソン病らしい特徴があるか、パーキンソン病らしくない特徴がないかを確認していきます。症状、以下に記載した検査に加え、L-ドパ製剤やドパミンアゴニストなどのパーキンソン病に対する薬を用いることで症状の改善がみられるかどうか、治療反応性を確認することも診断において重要です。パーキンソン病の症状は個人差が大きく、専門家であっても非典型的な症例では病初期は診断に迷うケースも少なくありません。
嗅覚検査
パーキンソン病に特徴的な症状の一つとして嗅覚障害があります。嗅覚喪失や年齢や性別に比して嗅覚低下がないか検査します。
MIBG心筋シンチグラフィー検査
MIBGという放射性医薬品を用いた核医学検査と呼ばれる検査になります。MIBGは心臓の交感神経に取り込まれる物質であるため、どの程度MIBGが集積するかを画像化することで、心臓の交感神経の障害や分布を評価することができます。パーキンソン病では心臓の交感神経が障害、脱落するため、多くの症例で心臓への取り込み(集積)が低下します。ただし、発症して間もない方や振戦が強いタイプの方など必ずしもMIBGの取り込み低下がみられない例もあり注意が必要になります。また一部の内服している薬剤によっては結果が修飾されてしまうこともあります。
DAT スキャン
パーキンソン病はドパミン神経細胞が変性・脱落することで起こる疾患です。DATスキャンはイオフルパンという放射線医薬品を用いた検査であり、イオフルパンが線条体とよばれる場所でドパミン神経細胞にどの程度集積するかを画像化することで、ドパミン神経細胞の障害を評価することができます。パーキンソン病の場合はイオフルパンの線条体での集積が低下します。ただし、一部の内服している薬剤によっては結果が修飾されてしまうこともあります。
頭部CT検査、頭部MRI検査
パーキンソン病は一般的な頭部CT検査、頭部MRI検査では特徴的な異常がみられません。ただしパーキンソン病に似た症状を呈する病気では特徴的な異常を示すものも多く、それらの病気との鑑別のためには有用です。慶應義塾大学神経内科では、先進的MRI撮像法、解析法によるパーキンソン病の診断、病態把握に有用なMRI所見の探索を研究テーマの一つとしています。
薬物治療
概論
治療は内服薬による治療が主体で、症状を軽くして、日常生活を過ごしやすくすることを目指すものです。内服治療をしっかりと続けることで、症状を改善することが可能で、健康な方とほぼ同じように生活できることを目標とします。
パーキンソン病は神経変性疾患の中でも最も多くの薬剤が開発されています(表-2)。最近は内服薬だけでなく皮膚貼付剤(貼り薬)や皮下注射薬も使用されています。パーキンソン病は脳内のドパミンが不足してしまう病気ですので、不足しているドパミンを補うことが治療の中心になりますが、薬ごとに作用、役割が異なりますので、症状に応じて適切な薬を選んで治療を行っていきます(表-3)。
発症して数年が経ちますと薬の効果持続時間の短縮などの運動合併症を認めることもありますが、さまざまな工夫により調整が可能です。主治医または薬剤師の指導に基づき、しっかりと薬を飲み続けることが大切です。患者さんは自分がのんでいる薬の特徴、必要性を知っておくことが望ましく、主治医または薬剤師に気がねなく相談することをお勧めします。慶應義塾大学病院では、パーキンソン病患者さんを対象とした「薬剤師外来」を行っています。パーキンソン病の治療は基本的には「パーキンソン病診療ガイドライン2018」(日本神経学会監修)に従って行われますが、患者さん毎に症状は多様ですので、テーラーメイド治療が求められます。
表-2.パーキンソン病に対する主な薬剤
スクロールしてください
| L-ドパ/DCI合剤 | レボドパ/カルビドパ | |
|---|---|---|
| レボドパ/ベンセラジド | ||
| ドパミンアゴニスト | 麦角系 | ブロモクリプチン |
| ペルゴリド | ||
| カベルゴリン | ||
| 非麦角系 | プラミペキソール | |
| ロピニロール(張付剤も有) | ||
| アポモルヒネ(注射製剤) | ||
| ロチゴチン(貼付剤) | ||
| COMT阻害薬 | エンタカポン | |
| オピカポン | ||
| MAO-B阻害剤 | セレギリン | |
| ラサギリン | ||
| サフィナミド | ||
| ドパミン遊離促進薬 | アマンタジン | |
| ドパミン賦活薬 | ゾニサミド | |
| アデノシンA2A受容体拮抗薬 | イストラデフィリン | |
| 抗コリン薬 | トリヘキシフェニジル | |
| ノルアドレナリン前駆体 | ドロキシドパ | |
表-3.パーキンソン病に対する薬の作用
スクロールしてください
| 薬の種類 | 作用 |
|---|---|
| L-ドパ含有製薬 | パーキンソン病では、身体の運動を調節している神経に命令を送るドパミンという物質が不足しています。L-ドパは脳内で不足しているドパミンを補う薬で、ふるえ、こわばりなどの症状を改善し、スムーズに身体を動かすことができるようになります。 |
| ドパミンアゴニスト (ドパミン受容体刺激薬) |
ドパミンを受け取る部分(ドパミン受容体)を刺激して、その働きを活性化します。飲み薬だけではなく貼り薬、注射薬もあります。 |
| ドパミン代謝阻害薬 (COMT阻害薬、MAOB阻害薬) |
ドパミンを分解する酵素の働きを抑えることで、ドパミンの作用時間を長くします。 L-ドパの減量にも効果的です。 |
| ドパミン遊離促進薬 | 神経細胞からのドパミンの放出を促進します。 |
| ドパミン賦活薬 | 作用機序は十分解明されていませんが、ドパミンの放出促進など複数の機序が推定されています。 |
| アデノシンA2A 受容体拮抗薬 |
アデノシンA2A受容体を阻害することで興奮していた神経が抑制され運動症状が改善すると考えられています。 |
| 抗コリン薬 | ドパミンが減少することで神経伝達物質アセチルコリンとのバランスが崩れてしまい、アセチルコリンの働きが強くなってしまいます。この薬は、アセチルコリンの働きを抑えて、バランスを調整します。 |
| ノルアドレナリン補充薬 | 脳内でノルアドレナリンに変わり、パーキンソン病の進行に伴い不足してくるノルアドレナリンを補います。すくみ現象への効果がみられます。 |
各論
早期パーキンソン病の治療
認知症を合併しているなど精神症状を呈するリスクが高いもしくは当面の症状改善を優先させる特別な事情がある場合はL-ドパで治療を開始します。また、65歳以上発症で運動合併症のリスクが高くない場合はL-ドパで治療を開始します。これらの条件に当てはまらない場合はドパミン受容体刺激薬(ドパミンアゴニスト)もしくはモノアミン酸化酵素B(MAOB)阻害薬で治療を開始します。
L-ドパによる治療
主な薬剤名:ネオドパストン®,メネシット®,イーシードパール®, マドパー® など
非常に多種類ある薬の中でも主役はL-ドパ製剤です。ドパミンそのものを内服しても脳内に到達しないのですが、 前駆物質であるL-ドパは脳内に到達し、脳の中でドパミンに変換されて効果を発揮します。より効率的に脳の中に入っていために通常はドパ脱炭酸酵素阻害薬(カルビドパもしくはベンセラジド)との合剤(L-ドパ/DCI合剤)で使用されます。
若いパーキンソン病患者さんでは、多く使用することで、病気の進行と共にL-ドパの効果持続時間の短縮などの運動合併症を認めることがあります。悪心を来たす場合は制吐薬を併用します。
ドパミン受容体刺激薬(ドパミンアゴニスト)による治療
ドパミン受容体と結合して作用を発揮します。麦角系ドパミン受容体刺激薬は高用量で心臓弁膜症をきたすことがあることが分かっており、非麦角系ドパミン受容体刺激薬が第一選択となります。非麦角系ドパミン受容体刺激薬には以下の種類があります。
プラミペキソール
薬剤名:ビ・シフロール®, ミラペックス®
ミラペックスはビ・シフロールの徐放剤(徐々に薬物が放出されるように設計した製剤)であり、1日1回の内服で長時間の効果を示すものです。
ロピニロール
薬剤名:レキップ®, レキップCR®, ハルロピテープ®
レキップCR®はレキップ®の徐放剤で、1日1回の内服で長時間の効果を示すものです。ハルロピテープは貼り薬で、1日1回腹部などに貼付し皮膚から薬剤を吸収させます。24時間貼ることで夜間・早朝など飲み薬でカバーしづらい時間を含めた24時間に亘る症状の改善が期待できます。かぶれなどの皮膚症状に注意が必要で、適宜保湿剤、ステロイド入りの軟膏などを使用します。
ロチゴチン: ニュープロパッチ®
ニュープロパッチ®は貼り薬で、1日1回腹部などに貼付し皮膚から薬剤を吸収させます。24時間貼ることで夜間・早朝など飲み薬でカバーしづらい時間を含めた24時間に亘る症状の改善が期待できます。かぶれなどの皮膚症状に注意が必要で、適宜保湿剤、ステロイド入りの軟膏などを使用します。
非麦角系ドパミン受容体刺激薬の副作用として突発的睡眠や眠気がみられることがあるため、非麦角系ドパミン受容体刺激薬を使用している患者さんは、自動車の運転、機械の操作、高所作業など危険を伴う作業には従事しないよう注意喚起がなされています。また、副作用で病的賭博、性欲亢進、買いあさり、むちゃ食いなど自分の欲望が抑えられないという症状(衝動制御障害)が起きることがあることも知られています。
MAOB阻害薬による治療
患者さん自身が作っているドパミン(内因性のドパミン)および内服したL-ドパ(外因性のドパミン)の脳の中での分解を阻害することで症状、運動合併症を改善する薬です。一部の抗うつ薬、トラマドール塩酸塩含有製剤などとの併用はできませんので注意してください。日本では早期パーキンソン病に対してはセレギリン(エフピー®)、ラサギリン(アジレクト®)の2種類が使用可能です。
進行期パーキンソン病の治療
発症して数年が経ちますと、L-ドパの効いている時間が短くなり薬がきれる感じを自覚するようになります。薬が効いている時間(オン)と効いていない時間(オフ)で症状の差を感じるようになるということです。そのような薬の効果持続時間の短縮による症状の日内変動をウェアリングオフ現象といいます。また、主に抗パーキンソン病薬の血中濃度が高い時に出現する体をくねらせるような不随意運動をジスキネジア(peak-doseジスキネジア)といいます。ウェアリングオフ現象とジスキネジアをまとめて運動合併症といい、これらを認めるようなった患者さんを進行期と呼ぶのが一般的です。進行期の治療はこれら運動合併症の治療は主となります。運動合併症の予防、治療のためには持続的にドパミン受容体を刺激するcontinuous dopaminergic stimulation(CDS) を達成することが重要だと考えられています。
進行期パーキンソン病の治療の概要を以下に記載しますが、進行期パーキンソン病患者さんの症状は非常に多様で全ての患者さんに共通した治療方法はなく、患者さん毎に治療のやり方は異なります。
ウェアリングオフ現象の治療
薬が効かなくなってきた時には、効いている時間が短くなったのか(ウェアリングオフ現象)、L-ドパを内服しても効いてくるまでに時間がかかるようになったのか(delayed on)、薬を内服しても効かない時があるのか(no on現象)の見極めも重要です。
ウェアリングオフ現象に対しては、まずはL-ドパ製剤の量、内服回数を増やす (4~5回/日)、もしくはドパミン受容体刺激薬を追加、増量することを検討します。それでも改善が不充分な場合はL-ドパが血中で分解されてしまうのを阻害するカテコール-O-メチル基転移酵素(COMT)阻害薬、脳の中での分解を阻害するMAOB阻害薬、アデノシンA2A受容体拮抗薬 またはゾニサミドを追加します。いずれも併用は可能ですが、薬の効きすぎによるジスキネジアの悪化には注意が必要です。また、薬の錠数が増えて飲み方も複雑になりすぎないように注意する必要があります。
COMT阻害薬
薬剤名:エンタカポン (コムタン®, スタレボ®), オピカポン (オンジェンティス®) スタレボはL-ドパ製剤 100 mg とエンタカポン100mgの合剤です。オンジェンティス®は1日1回の内服で効果を示すCOMT阻害薬です。
MAOB阻害薬
薬剤名:セレギリン (エフピー®), ラサギリン (アジレクト®), サフィナミド (エクフィナ®)
アデノシンA2A受容体拮抗薬
薬剤名:イストラデフィリン (ノウリアスト®)
ドパミン賦活薬
薬剤名:ゾニサミド(トレリーフ®)
ウェアリングオフ現象の治療としては薬物療法の他に、刺激発生装置やポンプなどの機械を用いるデバイス補助療法というものがあります。デバイス補助療法は適切な病状の患者さんに適切な時期に行うことが大切です。デバイス補助療法の詳細は次の章をご覧ください。
ジスキネジアの治療
ジスキネジアは通常、L-ドパの血中濃度が高くなりすぎた時に出現します (peak-doseジスキネジア)。ジスキネジアが日常生活に支障を来していなければ経過観察としますが、支障を来している場合は治療が必要です。L-ドパ製剤を少量ずつ頻回内服に変更し、1日を通して可能な限り均等な時間で薬を内服するように工夫します。また、塩酸アマンタジン (シンメトレル®) の内服を試みることもあります。長時間作用型のドパミン受容体刺激薬を追加しL-ドパの減量を試みるのも一手です。 これらの工夫で改善が無い場合はデバイス補助療法を考慮します。
delayed on現象、no on現象、オンオフ現象の治療
L-ドパを内服しても効いてくるまでに時間がかかるようになるdelayed on現象、薬を内服しても効かない時があるno on現象は、L-ドパの吸収障害が主な原因と考えられています。そのため、吸収を高める方法を試します。L-ドパの空腹時服用、懸濁液服用、1回服用量の増量などが有用です。本来であれば薬が効いているはずのタイミングで突然オフになってしまうオンオフ現象に対しては、ウェアリングオフ現象、delayed on現象、no on現象に対する治療に準じた対策を試みます。突然のオフに対するレスキュー薬としてはアポモルヒネ皮下注 (アポカイン®) も選択肢の一つです。デバイス補助療法の章をご覧になってください。
非運動症状の治療
パーキンソン病患者さんでは運動症状以外にも便秘、起立性低血圧、嗅覚低下、うつ、睡眠障害、認知症、幻覚など多彩な非運動症状がみられ、それぞれの症状に適切に対応する必要があります。一見パーキンソン病と関係なさそうに思われる症状でも、気になったことがあれば主治医に相談してみてください。
手術療法・デバイス補助療法
病気の進行に伴い、症状の日内変動(ウェアリングオフ現象)、主に薬がよく効いている時間に体がクネクネと動いてしまう(ジスキネジア)、生活に影響を与えるような振戦(ふるえ)などの症状が出現することがあります。このような症状に対して内服薬での調節が難しくなった場合、手術療法、デバイス補助療法を行うことがあります。
刺激発生装置やポンプなどの機械を用いる治療をデバイス補助療法と呼び、英語ですとdevice aided therapyですので頭文字をとってDATダットと呼ぶこともあります。具体的には、脳深部刺激療法、レボドパ/カルビドパ配合経腸用液療法、ホスレボドパ/ホスカルビドパ水和物持続皮下注、アポモルヒネ皮下注といったものがあります。
脳深部刺激療法(Deep Brain Stimulation: DBS)
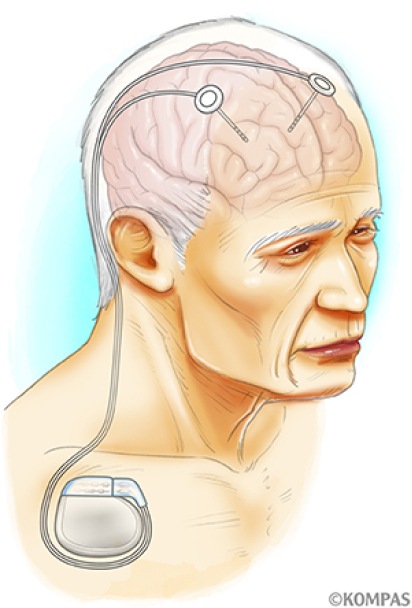
脳深部刺激療法は、脳の中の神経核にボールペンの芯ほどの太さの電極を挿入し、前胸部に埋め込んだパルス発生器(IPG)から発生させた電気信号で高頻度刺激を行うことでパーキンソン病の症状を改善させる治療です。進行期のパーキンソン病患者さんに行うことで症状のウェアリングオフ現象やジスキネジアといった運動合併症、薬剤抵抗性の振戦(ふるえ)を軽快することが期待されます。電極とIPGは前頭部から前胸部まで皮下を通じてリードで接続されます(図-2)。刺激部位は症状により異なりますが、視床下核(ししょうかかく)、淡蒼球内節(たんそうきゅうないせつ)、視床(ししょう)と呼ばれる部位のいずれかになります。近年、技術の進歩により刺激に方向性を持たせることや脳内の微小電場を感知することで、より良い症状の改善と副作用の予防が可能となってきています。手術後も症状の変化に対応して刺激パラメータ(刺激の強さなど)の細やかな調整が可能です。手術自体に伴う合併症、刺激に伴う合併症などがあり得るため適応は慎重に考慮する必要があります。若い患者さん、L-ドパがよく効く患者さん(反応性が良好な患者さん)ほど手術の効果は高いとされています。慶應義塾大学病院では、手術の安全性も考慮して75歳以下の患者さんを適応としています。DBSは適切な病状の患者さんに適切な時期(早すぎても遅すぎてもいけません)に行えば非常に効果的な治療です。DBSを安心・安全に行うために、約1~2週間検査入院していただき、適応があるかどうか(手術を行うか否か)を慎重に多職種で判断する診療体制をとっています(図-3)。
慶應義塾大学病院KOMPASから許可を得て転載
図-2. 脳深部刺激療法
(https://kompas.hosp.keio.ac.jp/disease/000997/より引用)
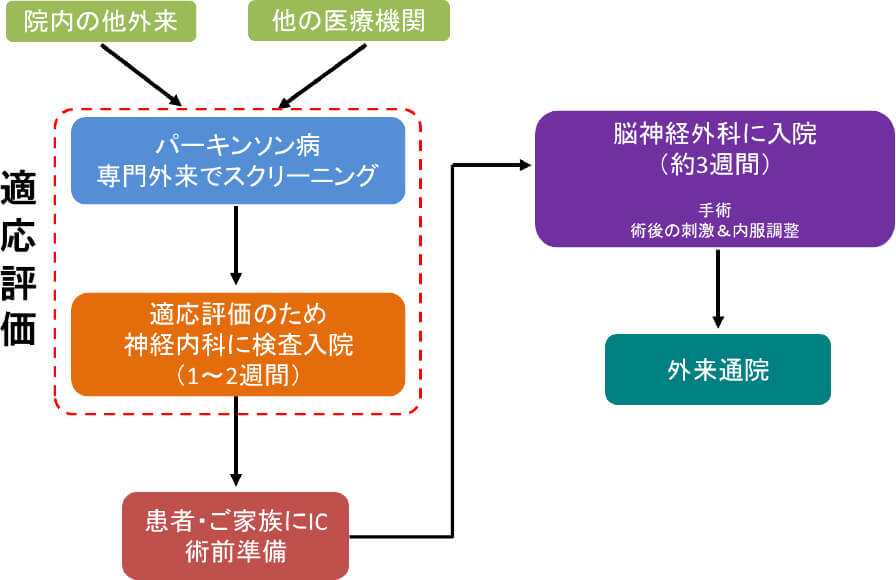
図-3. 慶應義塾大学病院におけるDBS診療の流れ
レボドパ/カルビドパ配合経腸用液療法
(Levodopa-carbidopa continuous infusion gel therapy:LCIG、デュオドーパ®)
レボドパ・カルビドパ配合経腸用液療法はゲル状になったレボドパ製剤(レボドパ/カルビドパ水和物配合剤)を胃ろうから挿入したチューブを通して空腸に持続的に投与する治療です。薬の投与のために専用の注入ポンプを用います。レボドパ(L-ドパ)の吸収部位である空腸に直接持続的に薬を投与することで血液中の薬の濃度が安定し、ウェアリングオフ現象やジスキネジアといった運動合併症が軽快することが期待されます。ポンプの流速(薬の投与量)を調整することで、症状の変化に対応した調整が可能です。当院ではまずは鼻から挿入した管を介して本薬剤を投与して治療の効果を実感していただいた後、効果が認められた患者さんに対して胃ろうを作成しています。1日の使用時間は最大16時間で、残りの時間は内服薬などで対処する必要があります。また、チューブの閉塞を予防するため、チューブのお手入れを毎日行う必要性があります。
ホスレボドパ・ホスカルビドパ水和物持続皮下注(ヴィアレブ®)
レボドパ/カルビドパのプロドラッグであるホスレボドパ/ホスカルビドパ水和物を体外のポンプで持続的に皮下注射することで、症状の日内変動(ウェアリングオフ)の改善を期待することができます。皮下注射であり他のデバイス療法と比較すると侵襲性が低いことが特徴の治療法です。皮下に投与するため皮膚トラブルが起こりえること、激しい運動は控えることなどに注意が必要です。ポンプの流速(薬の投与量)を調整することで、症状の変化に対応した調整が可能となります。2022年12月に日本で製造販売承認され、2023年10月から当院でも使用可能です。
アポモルヒネ皮下注(アポカイン®)
ドパミン受容体刺激薬であるアポモルヒネを専用の注入器(インジェクター)を用いて皮下注射する治療です。海外ではアポモルヒネの持続皮下注射が承認されていますが、日本では動けなくなってしまった時(オフ時)にレスキューとして注射することのみが承認されています。注射をする場所としては主にお腹や太ももです。注射すると約20分で効いてきて(即効性)、効果の持続時間は約1時間ですので、オフ状態から一時的にオン状態にするのに役立つ治療法です。注射は自己注射式で、患者さんもしくはご家族様が注入器に薬液をセットし、注射ボタンを押す必要性があります。
凝固術
手術療法のひとつでDBSと同様にパーキンソン病、ジストニア、振戦に対して行われています。DBSが脳の中の目標とする部位に電極を留置して電気刺激をすることで症状を改善する治療なのに対し、凝固術は熱で脳の中の特定の部位を凝固してくるという治療です。基本的には頭部の手術が必要で、片側のみ治療可能です。
MR下集束超音波療法(MRgFUS)
手術療法のひとつで2019年に本態性振戦、2020年にパーキンソン病に適応となりました。ふるえに対する効果が期待されています。治療は片側のみ可能で、全剃毛が必要ですが、開頭が必要なく、侵襲性が低い点が特徴です。
生活上の注意
パーキンソン病で不足するドパミンは、楽しいことや嬉しいことを期待してワクワクしている時に自然と放出されます。そのため、日常生活では、外出したり、ご家族や友人との会話、趣味やレクリエーションなどを楽しんだりして積極的な生活を送ることが大切です。リハビリを行う際はなるべく大きい動作を心掛け、筋力が落ちる前に行っておくことが重要です。ただし、薬の効果がとても良い時間と効き目が悪い時間帯が出てくることもあり、その日の体調、睡眠の状態、気持ちの状態でも症状は変化するため、薬の効きが悪く体が動きにくい時には、怪我をしないためにも無理をしないようにしなければなりません。またご本人だけではなく、ご家族の方にもパーキンソン病を良く知っていただき、患者さんをサポートしていただくことがより良い健康に重要となります。パーキンソン病は、症状が進行すると申請により公的支援を受けることができます。治療の内容によっては症状が比較的軽くても公的支援を受けることができる場合があり、担当医や最寄りの保健所・福祉窓口に相談されることをおすすめします。
チーム医療
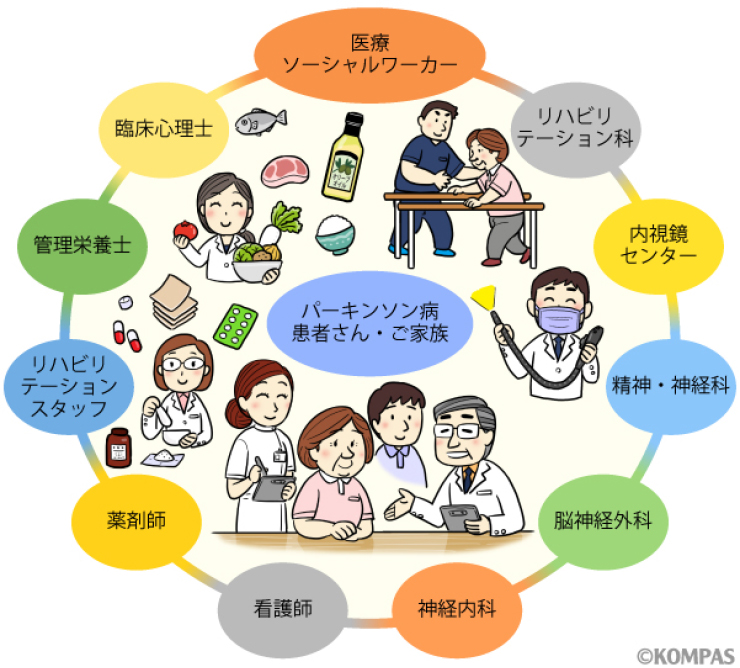
パーキンソン病患者さんに対する最適な医療は、一つの診療科や一人の医師のみの力では実現できず、近年多職種連携チーム医療の必要性が非常に高まっています。その背景には、運動症状のみならず非運動症状を含めた多彩な症状の包括的把握と対応の必要性、デバイス補助療法を含めた治療の複雑化、多彩な課題を抱える高齢パーキンソン病患者さんに対する全人的ケア・医療の提供の必要性といったことがあります。パーキンソン病患者さんに対する診療チームのメンバーには、医師、看護師、リハビリテーションスタッフ、薬剤師、栄養士、心理学者、医療ソーシャルワーカーなどが含まれますが、近年では患者さんやご家族もチームメンバーとなり、様々な意思決定に関与するチーム医療の在り方も提唱されています。また、高齢のパーキンソン病患者さんに対しては1つの医療機関の中でのチーム医療のみならず、行政、福祉、地域社会との連携(Interprofessional work)が非常に重要です。パーキンソン病に関する高度で幅広い専門知識を持ち、チーム医療の中心的な役割を担うパーキンソン病専門看護師(PDナース)が正式な的資格として認定されている国もありますが、日本ではPDナースは正式な資格としてはありません。そんな中、2022年4月から日本パーキンソン病・運動障害疾患学会(MDSJ)はパーキンソン病診療に携わるあらゆる職種の方を対象としたPDナース・メディカルスタッフ研修会を開始し、パーキンソン病療養指導士の認定を開始しました。
慶應義塾大学病院での取り組み
慶應義塾大学病院KOMPASから許可を得て転載
慶應義塾大学病院パーキンソン病センターは2022年10月に発足しましたパーキンソン病患者さんを専門に診療するセンターです。当センターでは複数の診療科、多くの医療職種が連携してパーキンソン病患者さんの診療にあたります。本センターの目的(理念)は「パーキンソン病に対するチーム医療を推進し、安心・安全に最適かつ先端的な医療を提供し、多職種でパーキンソン病患者さんの健康を支える」ことです。本センターの一番の特色はパーキンソン病患者さん、ご家族様の健康を支えるために非常に多くの診療科、医療職種がチームメンバーとなっている点です。具体的には様々な診療科の医師(神経内科、脳神経外科、リハビリテーション科、精神・神経科、内視鏡センター)に加え、看護師、薬剤師、リハビリスタッフ、臨床心理士、管理栄養士、メディカルソーシャルワーカーといった職種の方がメンバーとなっています。
各々の専門知識と技術を活用しながら、チーム内で目標・情報を共有し、互いに連携しながら外来および入院で診療にあたります。特に、脳深部刺激療法、レボドパカルビドパ配合経腸用液療法などのデバイス補助療法を行う際は適応評価から術後管理までチームで取り組んでまいります。
慶應義塾大学病院では脳深部刺激療法、レボドパ/カルビドパ配合経腸用液療法、アポモルヒネ皮下注を行うことが可能です。またホスレボドパ・ホスカルビドパ水和物持続皮下注は2023年10月から当院でも使用可能です。これらのデバイス補助療法の効果を最大限に発揮するためには適切なご病状の患者さんに適切な時期に行うことが非常に重要です。当院ではデバイス補助療法の適応判断から手術、術後管理まで複数の診療科、複数の部門からなるパーキンソン病センターが対応し、安心、安全に最適な治療を行う体制を整えています。
慶應義塾大学病院パーキンソン病センター外来のご案内
当センターの外来ご受診をご希望の方は、神経内科の火曜日午前(担当:関准教授・大草助教)、木曜午前(担当:大草助教)、土曜日午前(担当:二瓶専任講師)の初診外来にご紹介いただくようお願いいたします。 当院では月・火・金の午後にパーキンソン病の専門外来を行っています。また、木曜日にはデバイス補助療法専門外来も行っております。パーキンソン病センターの詳しい外来スケジュールはこちらをご参照ください。
スクロールしてください
| 月 | 火 | 水 | 木 | 金 | 土※ | |
|---|---|---|---|---|---|---|
| 午前 |
初診
(中原) |
初診
(関・大草) 再診 (二瓶) |
― |
デバイス 補助療法外来 (大草) 初診 (大草) |
― |
初診
(二瓶) |
| 午後 |
専門外来
(忽滑谷) |
専門外来
(関) |
― | ― |
専門外来
(関) |
再診
(二瓶) |

